Trong chương trình Hóa học lớp 8 thì mol là một trong những kiến thức mà bạn cần phải nắm rõ. Vậy mol là gì? Cách tính khối lượng mol, thể tích mol như thế nào? Hãy cùng với sieusach.info tìm hiểu những kiến thức thú vị về mol nhé!
Khái niệm mol là gì?
Kích thước và khối lượng của các nguyên tử, phân tử là rất nhỏ nên chúng ta không thể đo đếm được chúng. Tuy nhiên, trong Hóa học thì đòi hỏi cần phải xác định rõ có bao nhiêu nguyên tử, phân tử cũng như khối lượng, thể tích của chúng tham gia tạo thành trong một phản ứng hóa học.
Để có thể đáp ứng yêu cầu này thì các nhà khoa học trên thế giới đã đề xuất khái niệm cho các hạt vi mô (các hạt vô cùng nhỏ) đó chính là mol.
Theo SGK Hóa học 8 thì: “Mol là lượng chất có chứa 6,02.10^23 nguyên tử hoặc phân tử của chất đó. Con số 6,02.10^23 này được gọi là Avogadro và được ký hiệu là N”.
Mol được chia thành 2 loại là: mol nguyên tử và mol phân tử.
Ví dụ về mol:
– Một mol nguyên tử sắt chính là một lượng sắt có chứa N nguyên tử Fe.
– Một mol phân tử nước chính là một lượng nước có chứa N phân tử H2O.
Nồng độ mol là gì?
Trong dung dịch có chứa cả những chất tan và chất không tan. Lượng chất tan trong một thể tích dung môi cố định càng lớn thì nồng độ sẽ càng cao. Nồng độ này sẽ đạt đến giá trị cực đại khi mà dung dịch bão hòa, tức là chất tan gần như không thể hòa tan thêm vào dung dịch được nữa. Nếu như vẫn cố thêm chất tan vào thì hiện tượng phân tử bị kết tinh sẽ xảy ra. Điều này dẫn đến các pha cùng tồn tại hoặc tạo thể vấn (huyền phù).

– Nồng độ mol thể tích (m) biểu thị số mol của một chất tan cho trước trong 1 lít dung dịch. Ví dụ: trong 5 lít dung dịch có chứa 3 mol hạt tan tạo thành dung dịch 0,6 M hay còn gọi là 0,6 phân tử gam. Sử dụng mol có nhiều ưu điểm bởi nó cho phép đo số tuyệt đối các hạt có trong dung dịch, bất kể là khối lượng hay thể tích của chúng.
– Nồng độ mol khối lượng (m) biểu thị số mol của một chất cho trước trong 1 kg dung dịch. Ví dụ: 4kg dung môi chứa 3 mol hạt tan tạo thành dung dịch có nồng độ 0,75 mol/kg hay còn gọi là 0,75 molal.
– Nồng độ mol khối lượng là bất biến theo nhiệt độ và nó có liên hệ với khối lượng dung môi hơn là thể tích dung dịch. Chính vì vậy mà nồng độ mol khối lượng là một hằng số bất định, không hề phụ thuộc vào nhiệt độ và áp suất. Còn với nồng độ mol thể tích thì nó sẽ tăng khi nhiệt độ giảm.
Cách tính số mol là gì?
Cách tính khối lượng mol
- Cách tính khối lượng mol nguyên tử
Để tính khối lượng mol của một nguyên tố thì ta lấy khối lượng nguyên tử của chất đó nhân với hệ số chuyển đổi gam trên mol (g/mol).
Cụ thể công thức tính khối lượng mol nguyên tử như sau:
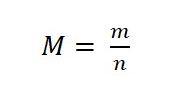
Trong đó:
– M: khối lượng mol, đơn vị là g/mol.
– m: khối lượng của chất đó, đơn vị là g.
– n: số mol chất, đơn vị là mol.
- Cách tính khối lượng mol phân tử
Khối lượng mol của một phân tử hay hợp chất sẽ bao gồm nguyên tử của nhiều nguyên tố khác nhau và nó bằng tổng khối lượng mol số nguyên tử có trong phân tử chất đó.
Xét trường hợp tổng quát với một hợp chất bất kì được cấu tạo bởi 3 nguyên tố hóa học. Ta có công thức hóa học tổng quát là AaBbCc trong đó:
– A, B, C: nguyên tố hóa học tạo nên hợp chất.
– a, b, c: số nguyên tử tương ứng với mỗi một nguyên tố.
Vậy ta có khối lượng mol của hợp chất trên được tính bằng công thức như sau:
Mhc = MA x a + MB x b + MC x c
Ví dụ 1: Tính khối lượng mol của phân tử nước có công thức hóa học H2O
Ta có: MH2O = MH2 + MO = (1 x 2 + 16) = 18 g/mol.
Ví dụ 2: Tính khối lượng mol của axit clohidric có công thức hóa học là HCl.
Ta có: MHCl = 1 + 35,5 = 36,5 g/mol
Cách tính thể tích mol của chất khí
Thể tích mol của chất khí chính là thể tích chiếm bởi N phân tử chất khí đó.
Trong điều kiện tiêu chuẩn (0°C và 1 atm) thì thể tích 1 mol chất khí là 22,4 lít.
Cách tính thể tích Mol của chất khí trong điều kiện tiêu chuẩn như sau:
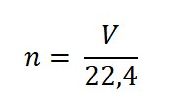
Trong đó:
- n: số mol.
- V: thể tích khí ở điều kiện tiêu chuẩn.
- 22,4: hằng số trong điều kiện tiêu chuẩn.
Lưu ý: Trong trường hợp chất khí ở trạng thái tự nhiên, không phải là điều kiện tiêu chuẩn thì công thức trên sẽ không thể áp dụng. Lúc này chúng ta sẽ cần tới những công thức và phép tính phức tạp hơn.
Cách tính phần mol trong dung dịch
Phần mol chính là số mol một thành phần của dung dịch chia cho tổng số mol của tất cả các chất có trong dung dịch đó.
Ví dụ: Xác định phần mol của NaCl trong dung dịch, trong đó 0,1 mol muối được hòa tan trong 100 gam nước.
Cách tính phần mol như sau:
Khối lượng riêng của H = 1 tuy nhiên có 2 nguyên tố H nên H2 = 2. Khối lượng riêng của O = 16.
H20 = 2 + 16 = 18.
MH20 = 100/18 = 5,56 mol.
XNaCl = mol muối / (mol muối + mol nước) = 0,1/(0,1 + 5,56) = 0,02.
Trên đây là những chia sẻ của chúng tôi liên quan đến mol là gì? Hy vọng bài viết này sẽ giúp bạn có thêm được nhiều kiến thức hay, phục vụ hữu ích trong quá trình học tập và làm việc.














![[Hỏi – Đáp] Vô duyên là gì? Ăn nói vô duyên là như thế nào? Lời nói vô duyên rất dễ khiến người khác khó chịu](https://mayruaxemini.vn/wp-content/uploads/2024/05/loi-noi-vo-duyen-rat-de-lam-nguoi-khac-kho-chiu-218x150.jpg)




